新闻动态
酰胺键的形成是合成化学中非常重要的一个反应,据统计,在药物化学工业,酰胺键的构建是应用最为广泛的化学反应,约占总反应类型数的25%[1]。2019年全球畅销的200种药物中约有1/3的药物含有酰胺键[2,3]。长期以来,发展高效的酰胺合成方法一直是合成化学的主要目标之一。而绿色环保的酰胺合成方法更是被美国化学会绿色化学研究所确定为一个关键研究领域并持续努力中[4]。
同时,酰胺键的形成是多肽和蛋白质合成领域中的一个最基础也是最核心的反应。科学家们经过长期的研究,开发了很多种构建酰胺键的方法,如混酐法、酰基叠氮法、缩合剂法等多种方法,但应用最广泛的依旧是缩合剂介导的酰胺合成方法。传统的缩合剂在反应效率,光学纯度,位阻,稳定性,分离等方面仍然存在着一些缺陷。此外固相多肽合成的低原子经济性给可持续发展带来了极大的挑战。因此,发展一种高效,简单,光学纯度好的缩合试剂是困扰研究人员的一大难题。
近年来,赵军锋教授团队围绕酰胺键的形成,致力于通过发展新试剂和新反应来解决多肽与蛋白质化学合成领域的难题。经过不懈努力,开发了一种结构全新的炔酰胺类缩合试剂-Ynamide,实现了高效,无消旋化构筑酰胺键[5]。
这类试剂代表产品是N-甲基乙炔基甲磺酰胺 (MYMsA)和 N-甲基乙炔基对甲苯磺酰胺(MYTsA),其分子量小,反应无需额外添加催化剂,对空气和水稳定,在近中性条件下几乎定量的得到目标酰胺,更重要的是含有α-手性中心的羧酸在缩合过程中不会发生消旋,图一为炔酰胺试剂的结构通式[6]。
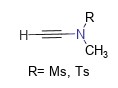
图一
赵教授团队开发的炔酰胺试剂应用广泛,可以用于普通酰胺和多肽片段,酯和大环内酯,硫代酰胺等的合成。下面将详细介绍这类炔酰胺缩合试剂在合成应用中的研究进展。
用于酰胺和多肽合成
炔酰胺介导的酰胺键合成在羧酸活化和氨解两步反应中均可以自发且高效的进行,于是赵教授课题组采用了两步一锅法,即不分离活化中间体,直接与胺进行后续反应,简化了操作过程。该方案具有很好的普适性,位阻大的底物以及手性氨基酸均可适用且不会消旋化,而且炔酰胺介导的反应不仅适用于合成酰胺,二肽,还可用于肽片段的合成(如带保护基的Leu-脑啡肽的合成)。另外,此类缩合试剂对许多官能团耐受性比较好,在OH, SH, CONH2,吲哚的NH等氨基酸侧链官能团的存在下均可以发生[6]。
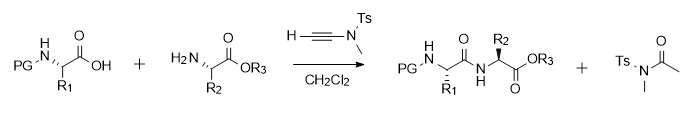
图二 酰胺合成
用于酯(硫酯)和大环内酯的合成
酯键是许多天然产物和精细化工产品的重要官能团,硫代羰基酯同样也是官能团转化的重要中间体,大环内酯更是众多药物,天然产物的核心骨架。由于炔酰胺试剂与羧酸反应的活化酯稳定性好,在冰箱储存可长达半年,赵教授课题组进一步拓展炔酰胺试剂的应用,开发了分子间的酯化和大环内酯的合成方案,如图三:在碱性条件下,乙腈作溶剂可以很顺利的实现酯化反应,对于手性α-氨基酸亦可以在DIEA催化下避免外消旋化的发生,底物普适性好,(硫)醇,(硫)酚均可适用。另外,大环内酯的合成存在消旋化,顺反异构化以及分子间聚合和关环副反应等问题,一直困扰着众多科研人员,赵教授课题组利用炔酰胺试剂成功的合成了大环内酯(图四),在对甲苯磺酸水合物催化下,依旧采用两步一锅法,在室温即便较高的浓度下也可以顺利合成大环内酯,有效的避免了外消旋化和顺反异构化等问题[7,8,9]。
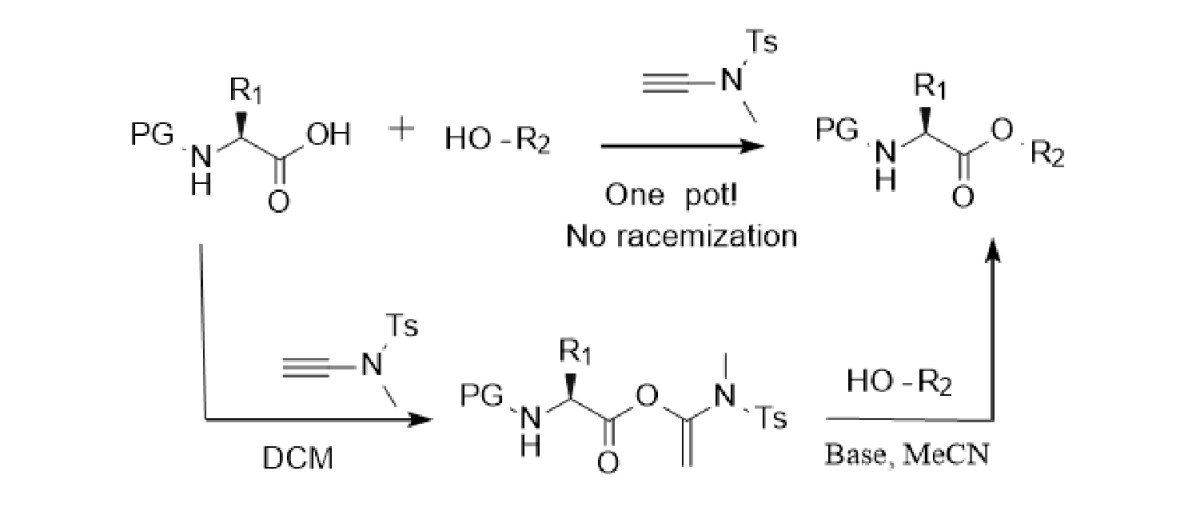
图三 分子间酯化
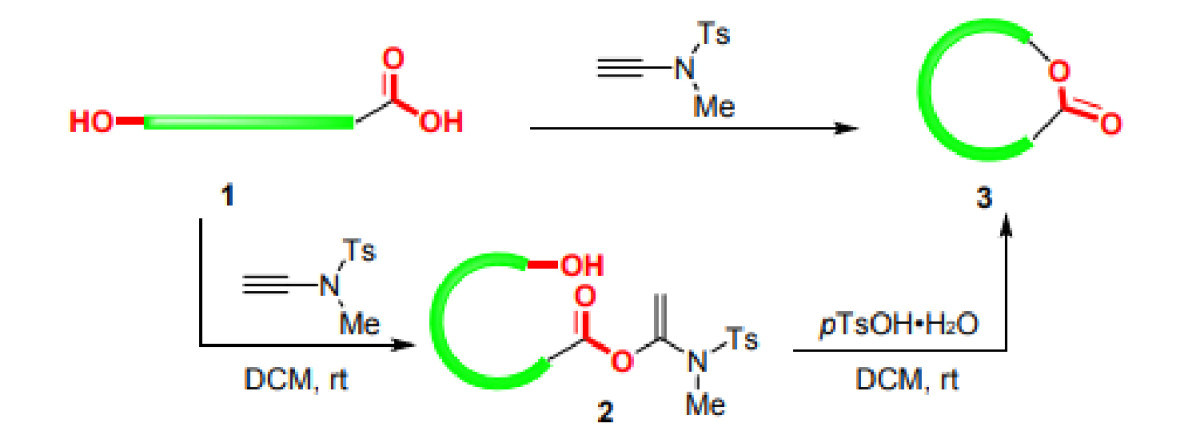
图四 大环内酯的合成
硫代酰胺和硫代多肽
多肽和蛋白质的精确修饰和功能化已成为化学生物学不可或缺的工具,硫酰胺键取代传统肽键可以获得不同的理化性质,如可以增强多肽对酶降解的抵抗力,以及独特的光谱特性制作探针等。由于合成方法上的局限性,硫代酰胺在蛋白质生物学领域的应用也受到限制。针对蛋白质和多肽中引入硫酰胺键的挑战,赵军锋教授课题组开发了以炔酰胺为介导的硫代酰胺合成方案,在二氯甲烷或者DMF中,可以无外消旋化的得到硫代酰胺,并且在固相多肽合成中,硫代羧酸与炔酰胺制备的活化酯中间体可以高效地转化成目标产物(除组氨酸外的其余19种天然氨基酸均可),从而为硫代酰胺在多肽和蛋白质化学生物学的研究奠定了基础[10,11]。
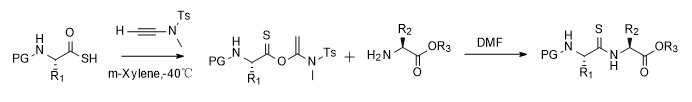
图五 硫代酰胺的合成
炔酰胺类缩合剂既兼具了传统缩合试剂和活化酯的优点,又弥补了其不足,为酰胺与多肽、酯与大环内酯、硫代多肽等重要物质的合成提供了新的方法,在多肽和蛋白质合成领域具有重要的科学意义。此外,经过我们科研人员的努力,苏州昊帆已能够提供炔酰胺类缩合试剂,同时,我们公司致力于酰胺,多肽合成试剂的研发和生产,经过二十年的发展和积累,本公司已成为全球最大,最全的酰胺合成试剂供应商,第一代至第四代缩合试剂均有在售,欢迎有需求的朋友来电垂询。
参考文献:
[1] Boström, J.; Brown, D.G.; Young, R.J.; et al. Expanding the medicinal chemistry synthetic toolbox[J]. Nat. Rev. Drug. Discov. 2018, 17, 709-727.
[2] Top 200 Drugs 2019——The Poster. https://www. pharmaexcipients.com/news/top-200-drugs-2019/ (accessed 2021-12-18)
[3] Magano, J. Large-Scale Amidations in Process Chemistry: Practical Considerations for Reagent Selection and Reaction Execution[J]. Org. Process Res. Dev. 2022, 26, 1562-1689.
[4] Bryan, M. C.; Dunn, P. J.; Entwistle, D.; et al. Key Green Chemistry research areas from a pharmaceutical manufacturers’ perspective revisited[J]. Green Chem. 2018, 20, 5082− 5103.
[5] Liu, T.; Xu, S.L.; Zhao, J.F. Recent Advances in Ynamide Coupling Reagent[J]. Chin. J. Org. Chem. 2021, 41, 873-887.
[6] Hu, L.; Xu, S.L.; Zhao, J.F.; et al. Ynamides as racemization-free coupling reagents for amide and peptide synthesis[J]. J. Am. Chem. Soc. 2016, 138, 13135-13138.
[7] Wang, X.W.; Yang, Y.; Zhao, J.F.; et al. Ynamide-Mediated Intermolecular Esterification[J]. J. Org. Chem. 2020, 85, 6188-6194.
[8] Yao, C.C.; Yang, J.H.; Zhao, J.F.; et al. Ynamide-Mediated Thionoester and Dithioester Syntheses[J]. Org. Lett. 2020, 22, 6628-6631.
[9] Yang, M.; Wang, X.W.; Zhao, J.F. Ynamide-Mediated Macrolactonization[J]. ACS Catal. 2020, 10, 5230-5235.
[10] Yang, J.H.; Wang, C.L.; Xu, S.L.; Zhao, J.F. Ynamide-Mediated Thiopeptide Synthesis[J]. Angew. Chem. Int. Ed. 2018, 58, 1382-1386.
[11] Yang, J.H.; Wang, C.C.; Zhao, J.F.; et al. Site-Specific Incorporation of Multiple Thioamide Substitutions into a Peptide Backbone via Solid Phase Peptide Synthesis[J]. J. Org. Chem. 2020, 85, 1484-1494.

